同温同压下,在4支相问体积的试管巾分別充有等体积的2种气体,它们是(1 ) NO和 O2 ( 2 ) NO2和 O2 ( 3 ) NO和 NO2 ( 4 )HCl和N2。现将4支试管均倒置于水槽中,充分反应后剩余气体的体积分别是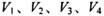 ,则下列关系正确的是
,则下列关系正确的是
A.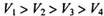 |
B.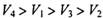 |
C.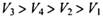 |
D.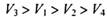 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH- |
| B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑ |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+ |
已知:CH3CH2CH2CH3(g)+6.5O2(g)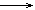 4CO2(g)+5H2O(l);DH =-2878 kJ∙mol-1
4CO2(g)+5H2O(l);DH =-2878 kJ∙mol-1
(CH3)2CHCH3(g)+6.5O2(g)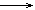 4CO2(g)+5H2O(l);DH =-2869 kJ∙mol-1下列说法正确的是
4CO2(g)+5H2O(l);DH =-2869 kJ∙mol-1下列说法正确的是
| A.正丁烷分子储存的能量大于异丁烷分子 |
| B.正丁烷的稳定性大于异丁烷 |
| C.异丁烷转化为正丁烷的过程是一个放热过程 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
恒温恒压,反应A+B=C+D,在下列哪种情况下,一定能自发进行
| A.△H<0 △S>0 | B.△H>0 △S>0 |
| C.△H<0 △S<0 | D.△H>0 △S<0 |
下列操作或记录的数据肯定正确的是
| A.用碱式滴定管量取16.00 mL KMnO4溶液 |
| B.用25 mL移液管量取20.00 mL盐酸溶液 |
| C.用托盘天平称取5.6 g食盐 |
| D.用标准盐酸滴定未知浓度的NaOH溶液消耗盐酸的体积为21.5 mL |
用0.1 mol/L的盐酸滴定0.1 mol/L的氨水,滴定过程中不可能出现的结果是
A.c(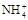 )﹥c(Cl-)﹥c(OH-)﹥c(H+) )﹥c(Cl-)﹥c(OH-)﹥c(H+) |
B.c(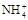 )=c(Cl-)﹥c(OH-)=c(H+) )=c(Cl-)﹥c(OH-)=c(H+) |
C.c(Cl-)﹥c(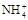 )﹥c(OH-)﹥c(H+) )﹥c(OH-)﹥c(H+) |
D.c(Cl-)﹥c(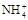 )﹥c(H+)﹥c(OH-) )﹥c(H+)﹥c(OH-) |