下列离子方程式书写正确的是
| A.向明矾溶液中加入过量的氢氧化钡溶液: Al3+ + 2SO42-+ 2 Ba2+ + 4OH-= AlO2- + 2BaSO4↓+ 2H2O |
| B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+ = Fe2++2H2O |
| C.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3?H2O |
| D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
CH2BrCOOH+OH- ="==" CH2BrCOO-+H2O
设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
| T/K |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
下列有关叙述正确的是
A.b>0 B.在973 K下增大压强,K2增大
C.a>b D.在常温下反应①一定能自发进行
下列说法正确的是
| A.焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 |
| B.熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 |
| C.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0 |
| D.ΔG<0的反应是自发的,因此在任何条件均可发生 |
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列表示甲烷燃烧热的热化学方程式中正确的是
| A.2CH4(g) + 4O2(g) ="=" 2CO2(g) + 4H2O(l)ΔH=―1780 kJ·mol-1 |
| B.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l)ΔH= +890 kJ·mol-1 |
| C.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l)ΔH=―890 kJ·mol-1 |
| D.2CH4(g) + 4O2(g) ="=" 2CO2(g) + 4H2O(l)ΔH=+ 1780kJ·mol-1 |
右图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得下图,则曲线a、b、c、d所对应的实验组别可能是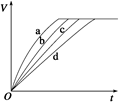
| 组别 |
c(HCl)(mol/L) |
温度(℃) |
状态 |
| 1 |
2.0 |
25 |
块状 |
| 2 |
2.5 |
30 |
块状 |
| 3 |
2.5 |
50 |
粉末状 |
| 4 |
2.5 |
30 |
粉末状 |
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3