下列叙述,能肯定判断某化学平衡发生移动的是
| A.混合物中各组分的浓度改变 | B.混合物的密度改变 |
| C.正、逆反应速率改变 | D.反应物的转化率改变 |
下列说法正确的是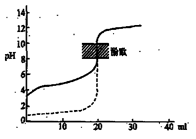
| A.△H>0的反应,常温下一定不能自发进行 |
| B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 |
D.恒容密闭容器中进行的反应3A(g) 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变 |
下表所列各组物质中,不能通过一步反应实现如图所示转化的是
| 物质 选项 |
a |
b |
c |
| A. |
Cu |
CuSO4 |
CuO |
| B. |
Fe |
FeCl3 |
FeCl2 |
| C. |
AlCl3 |
Al(OH)3 |
NaAlO2 |
| D. |
Na2O2 |
Na2CO3 |
NaOH |
下列有关物质的性质或应用的说法中正确的是
| A.铝合金是一种混合物,它比纯铝的熔点高 |
| B.高炉中的主要反应是高温下焦炭和氧化铁直接作用炼出生铁 |
| C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜 |
| D.电解从海水中得到的氯化镁溶液可获得金属镁 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D 与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是
与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是
A.原子半径:D>E>B>C>A
B.热稳定性:EA4>A2C
C.B、D可形成化合物D2B3
D.化合物DC与化合物EC2中化学键类型相同
下列离子方程式表达不正确的是
| A.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O |
| B.用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁: Mg(OH)2 +2NH 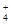 =Mg2++2NH3·H2O =Mg2++2NH3·H2O |
C.用惰性电极电解硫酸铜溶液:2Cu2++ 2H2O 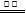 2Cu↓ +O2↑ +4H+ 2Cu↓ +O2↑ +4H+ |
D.酸性高锰酸钾和过氧化氢制取少量氧气:4MnO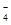 +4H2O2+12H+=4Mn2++7O2↑+10H2O +4H2O2+12H+=4Mn2++7O2↑+10H2O |