下列离子方程式与所述事实相符且正确的是( )
①将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO-
②漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO3-
③向Na[Al(OH)4]溶液中通入过量CO2制Al(OH)3:[Al(OH)4]-+CO2===Al(OH)3↓+HCO3-
④将铁粉加入稀H2SO4中:2Fe+6H+===2Fe3++3H2↑
⑤用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-===Mn2++Cl2↑+2H2O
⑥用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O
| A.③⑥ | B.⑤⑥ | C.①② | D.③ |
在一恒压密闭容器中充入1 mol NO2建立如下平衡:2 NO2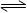 N2O4, 此时NO2的转化率为x%,在其他条件不变的条件下,再充入1 mol NO2,待新平衡建立时测得NO2的转化率为y%,则大小关系正确的是
N2O4, 此时NO2的转化率为x%,在其他条件不变的条件下,再充入1 mol NO2,待新平衡建立时测得NO2的转化率为y%,则大小关系正确的是
| A.x < y | B.x = y |
| C.x > y | D.无法确定 |
当反应Cl2+H2O HCl + HClO达到平衡后,欲使HClO的浓度增大,可以在氯水中加入
HCl + HClO达到平衡后,欲使HClO的浓度增大,可以在氯水中加入
| A.NaOH固体 | B.CaO固体 |
| C.CaCO3固体 | D.水 |
下图为铅蓄电池的示意图。下列说法正确的是
| A.放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-=PbSO4+2H2O |
| B.放电时,c(H2SO4)不变,两极的质量增加 |
| C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42- |
| D.充电时,若N连电源正极,则该极生成PbO2 |
已知碳酸钙的分解①CaCO3(s)==CaO(s)+CO2(g)仅在高温下自发;②氯酸钾的分解2KClO3(s)==2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是
| A.△H1=-178.32kJ·mol-1△H2=-78.3kJ·mol-1 |
| B.△H1=178.32kJ·mol-1△H2=-78.3kJ·mol-1 |
| C.△H1=-178.32kJ·mol-1△H2=78.3kJ·mol-1 |
| D.△H1=178.32kJ·mol-1△H2=78.3kJ·mol-1 |
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶1的化合物是
