下列关于反应热的说法正确的是( )
| A.在稀溶液中所有酸和碱反应的中和热数值都相等 |
B.已知C(s)+ O2(g)="CO(g)" △H=-110.5kJ/mol,说明碳的燃烧热为-110.5kJ/mol O2(g)="CO(g)" △H=-110.5kJ/mol,说明碳的燃烧热为-110.5kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A.1 mol NaHSO4晶体含有2NA个离子 |
| B.1 L 2 mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA |
C.1 mol C (碳正离子)中含有的电子数为10NA (碳正离子)中含有的电子数为10NA |
| D.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA |
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
| A.在0 ℃时,22.4 L氢气中含有2NA个氢原子 |
| B.电解食盐水若产生2 g氢气,则转移的电子数目为NA |
| C.1 mol乙烷分子中共价键总数为7NA |
| D.密闭容器中46 g NO2含有的分子数为NA |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.0.1 mol/L的100 mL FeCl3溶液中,含有的离子数为0.04NA |
| B.标准状况下,将m1克锌加入m2克20%的盐酸中放出n L H2,则转移电子数为nNA/11.2 |
| C.9 g D2O中含有的电子数为5NA |
| D.120 g由NaHSO4和KHSO3组成的混合物中共含有3NA的阴阳离子 |
NA表示阿伏加德罗常数的值。下列说法正确的是( )
| A.常温下,5.6 g Fe投入足量浓硝酸中,转移电子数目为0.3NA |
B.1 L 1 mol/L Na2CO3溶液中含有C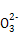 数目为NA 数目为NA |
| C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| D.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.0.5 mol/L MgCl2溶液中Cl-的数目为NA |
| B.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| C.常温常压下,22.4 L NO和N2的混合气体中分子数目大于NA |
| D.标准状况下,0.5 mol氦气含有的电子数为NA |