下列有关化学反应速率的说法正确的是( )
| A.凡是能量达到活化能的分子发生的碰撞均为有效碰撞。 |
| B.增大反应物浓度能加快正反应的反应速率,降低逆反应的反应速率 |
| C.温度升高使化学反应速率加快的主要原因是增加了反应物分子之间的碰撞次数 |
| D.决定化学反应速率的根本因素是参加反应的各物质的性质 |
下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+、Cl-、Na+、MnO4-、NO3-、SO42-
②使pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、HCO3-、NO3-、NH4+、S2O32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变红的溶液中:Fe3+、MnO4-、NO3-、Na+、SO42-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
| A.①②⑤ | B.①③⑥ | C.②④⑤ | D.①②④ |
能正确表示下列反应的离子方程式是
| A.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 (s)+ 2Fe3+(aq)= 2Fe(OH)3 (s)+ 3Mg2+(aq) |
| B.钠与CuSO4溶液反应:2Na + Cu2+ =" Cu↓" + 2Na+ |
| C.已知:酸的强弱H2CO3>HClO>HCO3-,则:2ClO-+ CO2(少量)+ H2O ===CO32-+ 2HClO |
| D.将足量的NaHCO3溶液加入少量澄清石灰水中:Ca2+ + OH- + HCO3- = CaCO3↓+ H2O |
NA代表阿伏加德罗常数的值。下列叙述正确的是
| A.60 g丙醇中存在的共价键总数为10 NA |
| B.50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C.钠在空气中燃烧可生成多种氧化物。23 g钠充分燃烧时转移电子数为1 NA |
D.235 g核素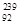 U发生裂变反应: U发生裂变反应: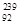 U + U + 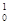 n n 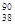 Sr + Sr + 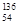 U + 10 U + 10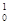 n净产生的中子( n净产生的中子(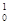 n)数为10 NA n)数为10 NA |
分类是化学学习与研究的常用方法,下列分类正确的是
| A.Na2O、MgO、Al2O3均属于碱性氧化物 |
| B.石灰石、生石灰、熟石灰均属于碱 |
| C.酸、碱、盐之间发生的反应均属于复分解反应 |
D.混合物、分散系、胶体从属关系如图所示 |
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且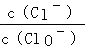 的值与温度高低有关.当n(KOH)="6a" mol时,下列有关说法错误的是
的值与温度高低有关.当n(KOH)="6a" mol时,下列有关说法错误的是
A.若某温度下,反应后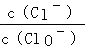 =11,则溶液中 =11,则溶液中 =0.5 =0.5 |
| B.参加反应的氯气的物质的量等于3a mol |
| C.改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol |
| D.改变温度,产物中KClO3的最大理论产量为2a mol |