某温度下在密闭容器中发生如下反应: 2A(g)+ B(g)  2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为( )
2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为( )
| A.20% | B.40% | C.60% | D.80% |
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2,HClO2,ClO2-,Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,各组分含量随pH变化情况如图所示(Cl-没有画出)。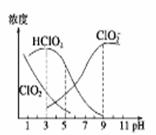
下列说法正确的是 ( )
| A.NaClO2溶液中,c(Na+)/c(ClO2-)=1 |
| B.往NaClO2溶液中滴入稀盐酸,当pH>6时,溶液中主要反应的离子方程式是:ClO2-+H+=HClO2 |
| C.使用该漂白剂的最佳pH为3.0 |
| D.此温度下HClO2的电离平衡常数的数值Ka=10-6 |
室温下,将1.000mol L-1盐酸滴入20.00mL 1.000mol
L-1盐酸滴入20.00mL 1.000mol L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。
L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。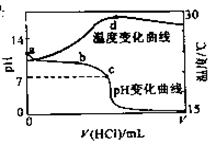
下列有关说法正确的是 ( )
A.a点由水电离出的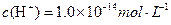 |
B.b点: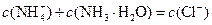 |
C.c点: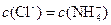 |
D.d点后溶液温度略下降的主要原因是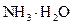 电离吸热 电离吸热 |
“魔棒”常被用于晚会现场气氛的渲染。“魔棒”发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如右图。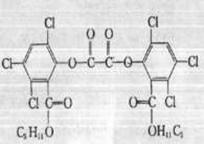
下列说法正确的是( )
| A.CPPO难溶于水 |
| B.CPPO属于芳香烃也属于高分子化合物 |
| C.1mol CPPO与NaOH稀溶液反应(不考虑苯环上氯原子水解),最多消耗4mol NaOH |
D.1mol CPPO与氢气完全反应,需要10 mo l H2 l H2 |
25 ℃时,几种弱酸的电离常数如下:
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25 ℃) |
1.8 ×10-5 |
4.9 ×10-10 |
K1="1.3" ×10-7 K2="7.1" ×10-15 |
下列说法正确的是( )
A. 等物质的量浓度的各溶液pH关系为: pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CN-),则a一定大于b
C. NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c( S2-)
S2-)
D. 某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)⇋ C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ , Ⅲ ,Ⅳ。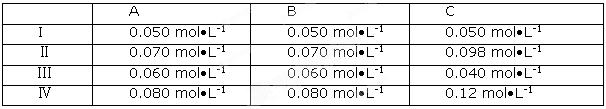
针对上述系列试验,下列结论中错误的是( )
| A.由I中数据可计算出该温度下反应的平衡常数是K="20" mol-1•L. |
| B.Ⅱ可能是通过增大C的浓度实现的 |
C.若Ⅲ只是升高温度, 则与I比较,可以判断出正反应一定是放热反应 则与I比较,可以判断出正反应一定是放热反应 |
| D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现 |