能正确表示下列化学变化的离子方程式是
| A.碳酸钙与盐酸反应 CO32 -+ 2 H+ = CO2↑+ H2O |
| B.金属铁放入稀盐酸中 Fe + 2H+ = Fe2+ + H2↑ |
| C.氯化亚铁溶液中通入氯气 Fe2+ + Cl2 = Fe3+ + 2Cl- |
| D.二氧化锰与浓盐酸反应 MnO2 + 4HCl = Mn2+ + 2Cl- + Cl2↑+2H2O |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,Kw不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,C(H+)=C(OH-)-2C(H2S) -C(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
科研人员设想用如图所示装置生产硫酸,下列说法正确的是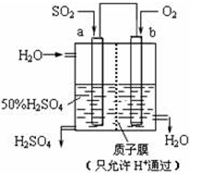
| A.A为正极,B为负极 |
| B.生产过程中A电极质量减轻 |
| C.电子从B极向A极移动 |
| D.负极反应式为:SO2-2e-+ 2H2O = SO42-+ 4H+ |
如图所示,A、B是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
A.断开K2,闭合K1时,A极上的电极反应式为:4OH¯一4e¯===O2↑十+2H2O
B.断开K2,闭合K1一段时间,溶液的pH要变大
C.断开K1,闭合K2时,B极上的电极反应式为: 2H++2e¯===H2↑
D.断开K1,闭合K2时,OH¯向B极移动
将100 mL 1 mol/L的NaHCO3溶液等分成两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中C(CO32-)的变化分别是
| A.减小、减小 | B.减小、增大 | C.增大、增大 | D.增大、减小 |
在一定温度下,将气体X和气体Y各0. 16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大