下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液若保存不当常呈黄色。
回答下列问题:
(1)A的电子式为 ;B分子属于 分子(极性、非极性);
(2)反应①的化学方程式为 ,
反应②的离子方程式为 ,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为 L。
(4)检验K中阳离子常用的方法是 。
(5)L浓溶液的保存方法是 。
顺丁橡胶及高分子生物降解性材料PBS、聚γ-BL的合成路线如下:
已知: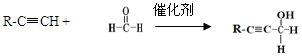
(1)B为饱和烃的含氧衍生物,用系统命名法命名,其名称为。
(2)D的官能团名称是。
(3)由B生成F的反应类型是。
(4)顺丁橡胶的顺式结构简式为。
(5)写出E与B聚合生成PBS的化学方程式。
(6)E有多种同分异构体,同时满足以下两个条件的同分异构体共有种,其中一种同分异体的核磁共振氢谱有两个吸收峰,峰面积之比为2:1, 其结构简式为。
a.含有酯基,不含醚键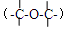
b.1mol该有机物与足量银氨溶液反应,生成4mol Ag
(7)由乙炔生成A的化学方程式为。
(8)由C生成聚γ-BL的化学方程式为。
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验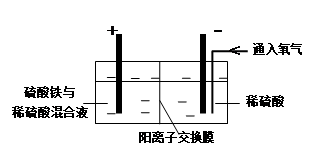
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是;加入有机萃取剂的目的是。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是。
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g)ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g)ΔH =" -92.4" kJ/mol
2NH3 (g)ΔH =" -92.4" kJ/mol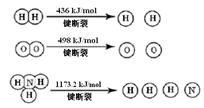
计算断裂1 mol N≡N键需要能量kJ , 氮气分子中化学键比氧气分子中的化学键键(填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) =" 2NO" (g)ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 |
H2 |
NH3 |
|
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
| 丙 |
0 |
0 |
4 |
判断乙容器中反应进行的方向。(填“正向”或“逆向”)
达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为。
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式。
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为。
(3)下列措施能增强84消毒液杀菌能力的是。
A.加入适量醋酸 B.加入适量亚硫酸 C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为。
下图是部分短周期元素的常见化合价与原子序数的关系图: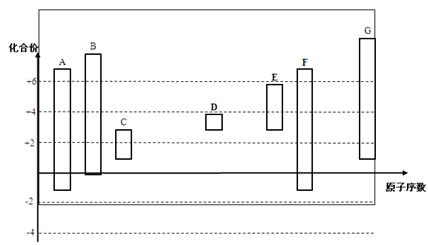
(1)元素A在周期表中的位置。
(2)用电子式表示D2G的形成过程其所含化学键类型为。
(3)C2-、D+、G2-离子半径大小顺序是>>(用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。 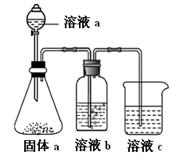
① 溶液a和b分别为,。
② 溶液c中的离子方程式为。
③请从原子结构的角度解释非金属性B > A的原因。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为。
② 用一个离子方程式表示该反应。