某温度下 ,H2(g)+CO2(g)
,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K= 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/ mol·L—1 |
0.010 |
0.02 0 0 |
0.020 |
| c(CO2)/ mol·L—1 |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
| A.平衡时,乙中CO2的转化率大于60% |
| B.平衡时,甲和丙中H2的转化率均是60% |
| C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L—1 |
| D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
下列系统命名法正确的是 ()
| A.2-甲基-4-乙基戊烷 | B.2,3-二乙基-1-戊烯 |
| C.2-甲基-3-丁炔 | D. 1,5-二甲苯 |
溴乙烷中含有少量乙醇杂质,下列方法中可以除去该杂质的是( )
| A.加入浓硫酸并加热到170℃,使乙醇变成乙烯而逸出 |
| B.加入氢溴酸并加热,使乙醇转化为溴乙烷 |
| C.加入金属钠,使乙醇发生反应而除去 |
| D.加水振荡,静置分层后,用分液漏斗分离去水层 |
下列关于有机物的说法错误的是( )
| A.CH4和Cl2在光 照条件下反应的产物最多可能有四种 |
| B.CH3CH2OH是一种可再生的能源 |
| C.乙烯的结构简式为CH2===CH2 |
| D.从乙烯出发可经先加成后氧化制得乙醛 |
.最简式相同,但既不是同系物,又不是同分异构体的是( )
①辛烯和3-甲基-1-丁烯 ②苯和乙炔 ③1-氯丙烷和2—氯丙烷④甲基环己烷和乙烯
| A.①② | B.②③ |
| C.③④ | D.②④ |
下列物质中既属于芳香化合物又属于醇的是( )
A. |
B. |
C.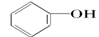 |
D. |