一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
| A.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
B.保持温度和活塞位置不变,在甲中 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
D.保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
下图所示的实验装置或操作不能达到实验目的的是
 |
 |
|
 |
||
| A.配制100 mL 0.1 mol /L盐酸 |
B. 验证AgCl和Ag2S的溶解性 |
C.测定中和反应 的反应热 |
D.实验室制取 并收集氨气 |
海水是巨大的资源宝库,下列关于海水综合利用的说法错误的是
| A.海水制淡水主要有蒸馏法、电渗析法、离子交换法等 |
| B.海水制盐、发展氯碱工业都是发生物理变化 |
| C.海水提溴过程中先通入Cl2将溴离子氧化为溴单质 |
| D.工业上用电解熔融MgCl2的方法制取金属镁 |
下列解释事实的化学用语正确的是
A.CO2的水溶液显酸性: H2CO3  2H++CO32- 2H++CO32- |
B.电子式表示氯化氢气的形成过程: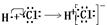 |
| C.AlCl3溶液中加入过量氨水:Al3++4NH3•H2O =AlO2-+ 4NH4++2H2O |
| D.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深: |
Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+
2CrO42-(黄色) +2H+
下列说法正确的是
| A.CHCl=CHCH3不存在顺反异构 |
| B.油脂在酸性、碱性条件下都能水解,水解产物相同 |
| C.蛋白质溶液中加入饱和Na2SO4溶液,可使蛋白质析出,从而进行分离 |
| D.淀粉溶液与稀硫酸共热,再加新制Cu(OH)2共热,无红色沉淀,证明淀粉没水解 |
下列图片中的资料对应的说法正确的是
| A |
B |
C |
D |
|
| 资料 |
 聚乙烯可做 包装材料 |
 分类收集垃圾有利于资源的回收利用 |
 水果、蔬菜、肉类都含重要的营养物质 |
 服用补铁剂同时服用Vc片 |
| 说法 |
无毒,用于食品、药品包装 |
废旧手机电池放入此标志的垃圾桶 |
柠檬是酸性食品,肉类是碱性食品 |
利用Vc酸性OTC表示非处方药 |