课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是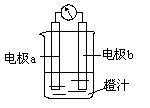
| A.原电池是将化学能转化成电能的装置 |
| B.原电池由电极、电解质溶液和导线等组成 |
C.上图中a极为镁条、b极 为锌片时,导线中会产生电流 为锌片时,导线中会产生电流 |
| D.上图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
有a、b、c、d四种元素。a、b的阳离子与c、d的阴离子具有相同的电子层结构;a
的阳离子的正电荷数小于b的阳离子的正电荷数,c的阴离子的负电荷数大于d的阴离
子的负电荷数。则它们的离子半径的关系是
| A.a>b>c>d | B.c>d>a>b | C.c>a>d>b | D.b>a>d>c |
下列关于化学键的说法正确的是:
①HF是一种非常稳定的化合物,这是因为分子间存在氢键
②NaCl熔化离子键发生了破坏
③CO2、SiO2熔点后者高是因为前者克服分子间作用力后者熔化破坏共价键
④活泼金属与非金属化合时,一定能形成离子键
⑤离子化合物中可能同时含有离子键和共价键
⑥由非金属元素形成的化合物一定不是离子化合物
⑦单质分子中一定含非极性键
| A.①②⑤ | B.④⑥⑦ | C.①③④ | D.②③⑤ |
右边是周期表中的短周期的一部分,若这些元素的原子之间均能形成共价键,则形成的共用电子对偏移程度最小的是: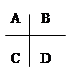
| A.BC | B.BD | C.AD | D.AB |
水和重水分别跟金属钾反应,若两反应中电子转移总数相等时,下列物质的化学量相等的是:①消耗水和重水的质量;②同温同压下生成气体的体积;③生成气体的质量; ④参加反应的钾的质量。
| A.①③ | B.②④ | C.①④ | D.②③ |
下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是
| A.氯气 二氧化碳 氢氧化钠 | B.氯化钠 氦气 氢氧化钠 |
| C.氯化钠 过氧化钠 氯化铵 | D.氯化钠 过氧化氢 氯化铵 |