(14分)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH= ;
(2)丙溶液中存在电离平衡为 (用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为 ;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是 (填“图1”或“图2”);
②a= mL。
某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为: c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L, c(Cl-)=1.6×10-5 mol/L,c(NO3-)=1.4×10-5 mol/L,c(Ca2+)=1.5×10-5 mol/L,则该废水的pH为__________。
在一定条件下,可逆反应:mA+nB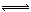 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是。
(2)A、C是气体,增加B的量,平衡不移动,则B为态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(4)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大两个单位,C的质子数比B多4个,1 mol A的单质与酸反应,能置换出1 g H2,这时A转化为具有与氖原子相同的电子层结构的离子。则A的原子结构示意图为_______①________,B离子的核外电子排布式为________②________,C原子外围电子的轨道表示式为_________③_______。
氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
(1)10 min内以NH3表示的平均反应速率;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
(3)第1次平衡的时间范围为:,第2次平衡的时间范围为:,第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:① 曲线发生变化的原因:② 达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”)
(14分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000 mL溶液。除烧杯外,还需要的玻璃仪器有___________、、_。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______式滴定管。②滴定时双眼应。
③有关数据记录如下:
| 测定序号 |
待测溶液的体积/mL |
所耗盐酸标准液的体积/mL |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.78 |
| 2 |
20.00 |
1.20 |
21.32 |
(3)计算纯度:烧碱样品的纯度是_________________。
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___________;
③读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。