已知可逆反应:2SO2(g) + O2(g)  2SO3(g);△H=-Q1 kJ·mol-1,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
2SO3(g);△H=-Q1 kJ·mol-1,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
| A.Q1=Q2 | B.Q1<Q2 | C.Q1>Q2 | D.无法比较 |
常温下,向0.1mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是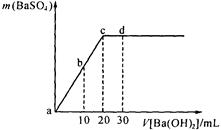
A溶液的pH:a<b<c<d B溶液的导电能力:a>b>d>c
C a、b溶液呈酸性 D c、d溶液呈碱性
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mlpH=11的NaOH溶液,混合液pH=7 |
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:5HClO2=4ClO2↑+H++Cl-+2H2O。向NaClO2溶液中滴加H2SO4,开始反应缓慢,随后反应迅速,其原因是
A在酸性条件下亚氯酸的氧化性增强 B溶液中的H+起催化作用
C ClO2逸出,使反应的生成物降低 D溶液中的Cl-起催化作用
现有可逆反应A(g)+2B(g) nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是
nC(g)(正反应放热),在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图所示,其中结论正确的是
Ap1>p2,n>3 Bp1<p2,n>3
Cp1<p2,n<3 Dp1>p2,n=3
在10mL pH=12的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是
A 0.01mol/L CH3COOH B 0.01mol/L HNO3
C pH=2的H2SO4溶液 D pH=2的CH3COOH溶液