如图:A处通入氯气,关闭B阀时,C处干燥的红色布条无变化,打开B阀时,C处红色布条褪色。由此作出的判断正确的是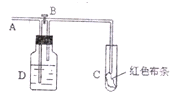
| A.D中可以是浓硫酸 | B.通入的氯气不含有水分 |
| C.D中可以是水 | D.D中不可以是NaOH溶液 |
pH相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌全部溶解且放出气体一样多,则下列说法正确的是
| A.反应开始时的速率:甲=乙 |
| B.反应所需时间:甲<乙 |
| C.反应开始时,酸的物质的量浓度:甲=乙 |
| D.反应结束时,溶液pH:甲<乙 |
恒温恒容条件下,进行以下反应:H2(g)+ Br2(g) 2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
| A.达平衡时HBr物质的量一定仍为a mol |
| B.两平衡压强比为3:(x+y+z) |
| C.达平衡时HBr的物质的量为(x+y+z)a/3 |
| D.x、y、z应满足的关系是 4x+z= 2y |
在一定温度下,反应AB(g)  1/2 A2(g)+1/2 B2(g)的平衡常数为0.1。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
1/2 A2(g)+1/2 B2(g)的平衡常数为0.1。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
| A.5% | B.17% | C.25% | D.33% |
将3 mol O2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系:3O2 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |