在100克浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加水的体积为(水的密度1 g/cm3)
| A.小于100mL | B.等于100mL | C.大于100mL | D.等于100/ρmL |
已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
| A.所得溶液中的[H+]=1.0×10-13mol·L- |
| B.加入Na2CO3固体,可能生成沉淀 |
| C.所加的烧碱溶液pH=13.0 |
| D.所得溶液中的[Mg2+]=5.6×10-10mol·L-1 |
在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH  CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是
| A.温度升高,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量醋酸钠固体,CH3COOH溶液的电离度增大 |
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)  nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是
nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是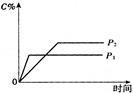
| A.P1>P2,n<3 |
| B.P1<P2,n=3 |
| C.P1<P2,n>3 |
| D.P1>P2,n>3 |
常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得的溶液pH
| A.等于7 | B.大于7 | C.小于7 | D.无法确定 |
用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是
| A.V1>V2>V3 | B.V1<V2<V3 | C.V1=V2>V3 | D.V1=V2<V3 |