下列装置或操作能达到实验目的的是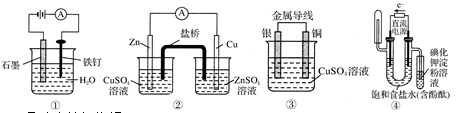
| A.①防止铁钉生锈 |
| B.②构成铜锌原电池 |
| C.③构成铜银原电池 |
| D.④验证NaCl溶液(含酚酞)电解产物 |
在25mL0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如右图所示,有关粒子浓度关系正确的是
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
B.在B点,a>25,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
同温下两种稀碱水溶液,碱甲溶液的物质的量浓度为c1,电离度为a1;碱乙溶液的量浓度为c2,电离度为a2,已知甲溶液的pH值小于乙溶液的pH值,下列有关叙述正确的是( )
| A.c1>c2 | B.a1<a2 | C.碱性:甲<乙 | D.无法判断 |
一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
| A.溶液中钡离子数目减小 |
| B.溶液中钡离子浓度减小 |
| C.溶液中氢氧根离子浓度增大 |
| D.pH值减小 |
将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
| A.NaOH溶液 | B.蒸馏水 | C.Na2SO3溶液 | D.KI溶液 |
Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是:
| A.[Na+]>[S2-]>[OH-]>[HS-]>[H+] |
| B.[Na+]+[H+]==[S2-]+[HS-]+[OH-] |
| C.[Na+]==[HS-]+2[H2S]+2[S2-] |
| D.[OH-]==[H+]+[HS-]+[H2S] |