向
和
的混合溶液中,逐滴加入
溶液。滴加
溶液的质量与生成沉淀的质量关系如下图,结合下图回答问题:

(1)写出生成沉淀的化学方程式:
(2)通过图像你能获得哪些信息(只答两点)。
①②
用元素符号或化学式填空:
①氩元素 ② 4个二氧化硫分子
③氮气 ④ 7个银原子
⑤ 3个硫酸根离子 ⑥碳酸钡
氮分子(N2)中的氮原子和氨气分子(NH3)中的氮原子,其核电荷数都是7,即N2和NH3两种物质都含有元素。
海洋不仅繁衍着无数水生生物,还蕴藏着丰富的化学资源,按目前测定,海水中含有的化学元素有80多种。海水中元素质量分数最高的是(填元素名称)。
由我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原于质量新值,其中他测定核电荷数为63的铕元素的相对原子质量新值为152,则该元素的原子中质子数=,中子数=,核外电子数=。
某元素A的原子结构示意图为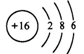
该元素原子的核电荷数为,
原子的最外层电子数是,A属元素。(填金属、非金属或稀有气体),A原子通过得失电子而形成的离子的符号是 。