下列叙述不正确的是
| A.NaCl的摩尔质量是58.5g/mol |
B.将wg a%的NaCl溶液蒸发掉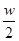 g水,得到2a%的NaCl溶液 g水,得到2a%的NaCl溶液 |
| C.将1体积cmol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2cmol/L |
| D.将5.85gNaCl晶体溶入1000mL水中,制得0.1mol/L的NaCl溶液 |
有8种物质:①甲烷;②苯;③聚乙烯;④聚异戊二烯;⑤2-丁炔;⑥立方烷;⑦邻二甲苯;⑧环辛四烯。既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是
| A.④⑤⑧ | B.④⑤⑦⑧ | C.③④⑤⑧ | D.③④⑤⑦⑧ |
(Ⅰ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的醇溶液混和加热;
(Ⅱ)1-溴丙烷与2-溴丙烷分别和氢氧化钠的水溶液混和加热,则
| A.(Ⅰ)产物相同,(Ⅱ)产物相同 | B.(Ⅰ)产物不同,(Ⅱ)产物不同 |
| C.(Ⅰ)产物相同,(Ⅱ)产物不同 | D.(Ⅰ)产物不同,(Ⅱ)产物相同 |
“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型中符合这一要求的是
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤酯化反应 ⑥加聚反应
| A.② | B.①④ | C.③⑤ | D.②⑥ |
据调查,劣质的家庭装饰材料会释放出近百种能引发疾病的有害物质,其中一种有机物分子的球棍模型如右图,图中“棍”代表单键或双键或三键,不同大小的球代表不同元素的原子,且三种元素位于不同的短周期。下面关于该有机物的叙述不正确的是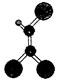
| A.有机物化学式为C2HCl3 | B.分子中所有原子在同一个平面内 |
| C.该有机物难溶于水 | D.可由乙炔和氯化氢加成得到 |
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇到乙醇迅速变成蓝绿色的Cr3+;下列对乙醇的4条描述中,与酒后驾车酒精测定原理有关的是:
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇有兴奋神经作用
| A.②③ | B.①③ | C.②④ | D.①④ |