在同一稀溶液中可以共存,加OH-有沉淀生成,加H+有气体生成的一组是
| A.Mg2+、CO32-、Cu2+、Cl- | B.HCO3-、Cl-、Ca2+、Mg2+ |
| C.OH-、NO3-、K+、Ca2+ | D.SO42-、H+、Al3+、NH4+ |
下列有关共价化合物的说法一定正确的是()
①具有较低的熔沸点②不是电解质③固态时是分子晶体
④都由分子构成⑤液态时不导电
| A.①③④ | B.②④⑤ |
| C.①②③④⑤ | D.只有⑤ |
关于氢键,下列说法正确的是()
| A.每一个水分子内含有两个氢键 |
| B.冰、水和水蒸气中都存在氢键 |
| C.没有氢键就没有生命 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法,不正确的是()
| A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体 |
C.NH5的电子式为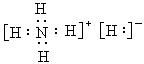 |
D.它与水反应的化学方程式为NH5+H2O NH3·H2O+H2↑ NH3·H2O+H2↑ |
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的粒子间只以单键结合。下列关于C3N4晶体的说法错误的是()
| A.该晶体属于原子晶体,其化学键比金刚石更牢固 |
| B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子 |
| C.该晶体中碳原子和氮原子的最外层都满足8电子结构 |
| D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构 |
图1-23是氯化铯晶体的晶胞(晶体中最小重复单元),已知晶体中两个最近的Cs+核间距离为a cm,氯化铯的相对分子质量为Mr,NA为阿伏加德罗常数。则氯化铯晶体的密度(单位:g·cm-3)为()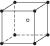
图1-23
A. |
B.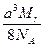 |
C. |
D.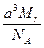 |