下列物质酸性 大小比较正确的是
大小比较正确的是
| A.H2SO4>CH3COOH | B.HClO3>HClO4 |
| C.H3PO4>HNO3 | D.H2CO3<HClO |
X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于()
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于()
| A.33% | B.40% | C.50% | D.66% |
一定温度下,可逆反应H2(g)+I2(g) 2HI(g)达到化学平衡状态的标志是()
2HI(g)达到化学平衡状态的标志是()
| A.混合气体的压强不再变化 | B.混合气体的颜色不再变化 |
| C.反应速率v(H2)="0.5v" (HI) | D.c (H2):c(I2):c(HI)=1:1:2 |
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是()
| A.稀NaOH溶液 | B.HCl溶液 | C.NaCl溶液 | D.酸性AgNO3溶液 |
在一定条件下,将 两种气体通入密闭容器中,反应按
两种气体通入密闭容器中,反应按

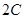 进行,2秒钟后反应速率如下:
进行,2秒钟后反应速率如下: ,
,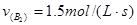 ,
,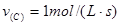 ,则x、y的值分别为( )
,则x、y的值分别为( )
| A.3和2 | B.1和3 | C.3和1 | D.4和5 |
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是()
2SO3(g)能增大正反应速率的措施是()
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |