用98%的浓硫酸(其密度为1.84g/cm-3)配制500mL 1.0mol·L-1稀硫酸,若实验仪器有:
A.蒸馏烧瓶 B.托盘天平 C.玻璃棒 D.50mL烧杯
E.10mL量筒 F.圆底烧瓶 G.100mL量筒 H.分液漏斗
(1)需量取浓硫酸的体积 为 mL。
为 mL。
(2)实验时 必须选用的仪器有(填序号) ,除此还必需的仪器有
必须选用的仪器有(填序号) ,除此还必需的仪器有
(3 )配制过程中,下列情况会使配制溶液的物质的量浓度偏高的是(填序号)
)配制过程中,下列情况会使配制溶液的物质的量浓度偏高的是(填序号)
①定容时俯视刻度 线观察液面 ②用量筒取浓硫酸时,仰视读数
线观察液面 ②用量筒取浓硫酸时,仰视读数
③定容摇匀后有少量溶液流出 ④用未干燥的量筒取浓硫酸
⑤配制前容量瓶中有水滴
(4)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度 ;向容量瓶 中转移溶液时不慎有液滴掉在容量瓶外面 。
中转移溶液时不慎有液滴掉在容量瓶外面 。
(5)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使 用容量瓶前检查它是否漏水
用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
用98%的浓H2SO4(ρ=1.84g/cm3)配制 240mL0.5mol/L的稀H2SO4,请按要求填空:
(1)请写出该实验的实验步骤
①,②,③,④,⑤。
(2)所用浓H2SO4的物质的量浓度为 ,配制时所需浓硫酸的体积为mL。(均保留一位小数)
(3)实验中需要用到的定量仪器有(包括规格)
(4)若实验中出现下列 现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
①浓硫酸溶解后未冷至室温即进行转移、定容。()
②定容时俯视刻度线。()
(5)若定容时液面高于刻度线应采取的措施是。
(6)若实验操作全部无误,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你帮助把标签上的内容写一下(如右图)。
某同学应用如下所示装置研究物质的性质。其中气体C的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题: 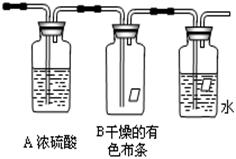
(1)该项研究的主要目的是_______。
(2)浓硫酸的作用是_______________。
(3)观察到的实验现象是___________________
(4)从物 质性质方面来看,这样的实验设计还存在事故隐患,事故表现在__。
质性质方面来看,这样的实验设计还存在事故隐患,事故表现在__。
右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧 瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的▲
(2)配制稀硫酸时,还缺少的仪器 ▲(写仪器名称)
(3)经计算,配制100 mL1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为▲mL,量取硫酸时应选用▲mL规格的量筒(填字母番号)
A.10 mLB.50 mLC.100 mLD.200mL
mLD.200mL
(4)在烧杯中稀释浓硫酸的实验操作为▲; 若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为 ▲。
▲。
(5)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的是▲。
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴 水至刻度处
水至刻度处
我省 自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。粗盐中含有Ca2+、Mg2+、SO42-以及泥沙等杂质,
自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的。粗盐中含有Ca2+、Mg2+、SO42-以及泥沙等杂质,
(1)为了除去粗盐中的泥沙,可采用的实验操作方法的名称是____▲____
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸。
其中,在步骤③中涉及的离子反应方程式有___▲; ▲。
(3)含碘食盐往往加入KIO3,为了检验实验中是否含KIO3,可以用以下反应进行:
KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
为了从反应后的溶液中提取得到纯净的I 2,可采用的实验操作方法的名称是___▲__。
2,可采用的实验操作方法的名称是___▲__。
某活动小组利用如图装置验证N0的还原性及探究工业生产硝酸的原理。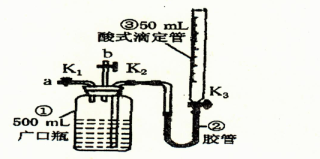
如何检查该装置气密性。
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管③中液面与①相平并记录滴定管③的刻度。
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作:;计算出通入的NO的体积为V mL(V<50)。
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,写出通入O2的过程中发生的化学反应方程式:。
(2)继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
I.当通入氧气的体积为V/2mL时,则广口瓶①的气体体积为;
II.当广口瓶①的气体体积为V/2 mL时,则通入氧气的体积可能为。