在重铬酸钾(K2Cr2O7)溶液中存在如下平衡: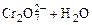



 , 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
, 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
| A.Ag2O | B.Ag2CrO4 | C.AgHCrO4 | D.Ag2Cr2O7 |
镁铝合金可用于飞机制造业,主要是利用了它的物理性质中的
| A.密度较小 | B.易导电 | C.易导热 | D.银白色 |
为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有()
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是()
| A.测定密度 | B.放入硝酸中 | C.放入盐酸中 | D.观察外观 |
室温下,取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为
| A.0.01 mol•L-1 | B.0.017 mol•L-1 | C.0.05 mol•L-1 | D.0.50 mol•L-1 |
pH相同的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌粒全部溶解且放出气体一样多,为此下列说法正确的是
| A.反应开始时的速率:甲<乙 | B.反应开始时,酸的物质的量浓度:甲<乙 |
| C.反应所需时间:甲<乙 | D.反应后溶液的pH:甲<乙 |