H2S溶液中,在采取措施使pH增大的同时,则c(S2-)的变化情况是
| A.增大 | B.减小 | C.不变 | D.可能增大,也可能减小 |
以下关于物质元素组成的说法正确的是()
| A.碱都含氢元素 | B.酸都含氧元素 |
| C.盐都含金属元素 | D.有机物都含碳、氢、氧元素 |
下列有关物质的性质和该性质的应用均正确的是()
| A.常温下浓硫酸与铝不发生反应,可在常温下用铝制容器贮藏贮运浓硫酸 |
| B.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C.二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、HCO3-、NO3- |
| B.1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42- |
| C.含有0.1 mol·L-1 Ca2+溶液:Na+、K+、CO32-、Cl- |
| D.澄清透明的溶液:Na+、K+、MnO4-、[Al(OH)4]- |
下列说法正确的是(其中NA表示阿伏伽德罗常数)()
| A.常温常压下,0.1mol 2H216O中含中子数、质子数、电子数均为NA |
| B.比黄金还贵的18O2和普通的16O2是两种不同的核素 |
| C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
| D.1L2mol·L-1的Al(NO3)3溶液中含Al3+个数为2NA |
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: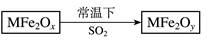
则下列判断正确的是()
| A.MFe2Ox是氧化剂 | B.SO2是该反应的催化剂 |
| C.x<y | D.MFe2Oy是还原产物 |