下列有关溶液物质的量浓度的说法正确的是
| A.把1 molNaCl溶于1 L水中所得溶液物质的量浓度为1mol/L |
| B.把0·1 molNaCl投入100 mL容量瓶中加水至刻度线,充分振荡后,浓度为1 mol/L |
| C.把7.4gCa(OH)⒉放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度,浓度为1 mol/L |
| D.需要78 mL 0.1 mol/L的Na2C03溶液,应选用l00 mL容量瓶 |
25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol.下列热化学方程式书写正确的是
| A.2H+(aq)+SO42—(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol |
| B.KOH(aq)+1/2H2SO4(aq)===1/2K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol |
| C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol |
| D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l);ΔH=-5518 kJ/mol |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.7.8 g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B.2 L 0.1 mol/L的醋酸钠溶液中,醋酸根离子数为0.2NA |
| C.5.6 g铁与足量的稀硝酸反应,失去电子数为0.2NA |
| D.SiO2晶体中,有NA个Si就有4NA个Si—O键 |
下列有关物质性质的比较中,正确的是
①沸点:H2O>HCl>HF ②密度:四氯化碳>水>汽油
③酸性:H3PO4>H2SO4>HClO4 ④离子半径:O2->F->Na+
| A.①③ | B.②④ | C.①④ | D.②③ |
25 ℃时,某硫酸铜溶液的质量分数为w,物质的量浓度为c mol·L-1,密度为ρ g·mL-1,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25 ℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是( )
A.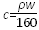 |
B. |
C.16a=9b | D.9a=16b |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
| 物质编号 |
物质转化关系 |
甲 |
乙 |
丙 |
丁 |
| ① |
 |
Cu |
CuO |
CuSO4 |
Cu(NO3)2 |
| ② |
Na2CO3 |
NaOH |
NaHCO3 |
CO2 |
|
| ③ |
(NH4)2SO3 |
CaSO3 |
SO2 |
NH4HSO3 |
|
| ④ |
CH3CH2Cl |
C2H5OH |
CH2=CH2 |
CH3CH3 |
A.①②③④ B.①②③ C.①③④ D.②④