 标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO3-,则原混合气体中H2的物质的量为
标准状况下,将a L H2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b mol NaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO3-,则原混合气体中H2的物质的量为
| A.a/2 mol | B.(a/22.4-b) mol |
| C.(a/22.4-b/2) mol | D.b/2 mol |
下列说法正确的是
| A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存 |
| C.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| D.氯水经光照有气泡逸出,该气体为HCl |
下列各组溶液中,可能大量共存的离子有
| A.含有大量 Ba2+的溶液中: HCO3-、 Ag+、 Fe3+、 Cl- |
| B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2- |
| C.由水电离的c (OH- ) = 10-14mol·L-1的溶液中:CH3COO-、C6H5O-、Na+、K+ |
| D.加入铝粉后产生氢气的溶液中: NH4 +、 Na+、 NO3-、Cl- |
下列装置或操作不能达到实验目的的是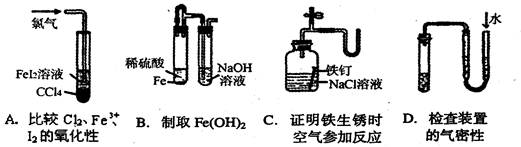
下列替代过程合理的是
| A.医院用BaCO3代替BaSO4作“钡餐” |
| B.家庭用食用醋代替CO2来增强漂白粉的漂白性 |
| C.工业上用电解AlCl3代替Al2O3来冶炼铝 |
D.实验室用Ca(OH)2溶液代替CaCl2溶 液来鉴别 液来鉴别 Na2CO3和NaHCO3 Na2CO3和NaHCO3 |