两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81g I2,反应的离子方程式为:Cr2O72-+I-+H+→Cr3++I2+H2O(未配平) 。若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为 ( )
A. |
B. |
C. |
D. |
下列分子式表示的物质一定是纯净物的是
| A.C5H10 | B.C7H8O | C.CH4O | D.C2H4Cl2 |
下列各组混合物中,用分液漏斗不能分离的是
| A.正己烷和水 | B.甲苯和水 | C.乙酸和乙醇 | D.溴苯和水 |
下列物质在水中最难电离的是
| A.CH3COOH | B.H2O | C.C6H5OH | D.C2H5OH |
某烷烃结构简式如图,其命名正确的是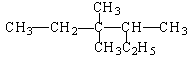
| A.2-乙基-3,3-二甲基戊烷 |
| B.3,3-二甲基-4-乙基戊烷 |
| C.3,3,4-三甲基己烷 |
| D.3,4,4-三甲基己烷 |
化学反应A2+B2====2AB的能量变化如图所示,则下列说法正确的是( )
| A.该反应是吸热反应 |
| B.断裂1 mol A—A键和1 mol B—B键能放出x kJ能量 |
| C.断裂2 mol A—B键需要吸收y kJ的能量 |
| D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |