现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过分析,认为无需 检验就可判断其中必有的两种物质是 和 (填化学式)。
检验就可判断其中必有的两种物质是 和 (填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生红褐色沉淀,向该沉淀中滴人稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为 。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液显 性,原因为 。(用离子方程式表示)
(4)将0.02 molA与0.0 1molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的物质的量为 (保留一位小数)
(5)将Cu投人到装有D溶液的试管中,Cu不溶解;再 滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的
滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的  (填相应的离子符号)。有关反应的离子方程式为: 。
(填相应的离子符号)。有关反应的离子方程式为: 。
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论 。
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B,C,D,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
。
(3)写出A、B两元素相互反应的化学方程式:
。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
。
在Na2S、KOH、CH4、Cl2、Na2O2、H2O2、NH4Cl中,只含有离子键的是__________,只含有极性键的是__________,含有非极性键的是__________,既含有离子键又有共价键的是______________________
在原子序数1—18号的元素中:
(1)与水反应最剧烈的金属是_________________。
(2)阳离子半径最大的是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物水溶液呈碱性的元素是_____________。
(5)气态氢化物最稳定的化学式是________。
(6)最高价氧化物对应水化物的酸性最强的酸是_____________。
①在实验室里,要证明钠、镁、铝的金属性依次减弱的实验,除钠、镁、铝以外,还需要的试剂为_________________________。
②在实验室里,要做证明Cl、Br、I的非金属性依次减弱的实验,所需的试剂除:NaCl溶液,NaBr溶液,KI溶液外,还需要的试剂为____________________。
反应的离子方程式为:_______________________________________________________
______________________________________________________
————————————————————————————。
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在可以设计成原电池的是。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中
电解池相连,其中,a为电解液,X和Y是两块电极板,则: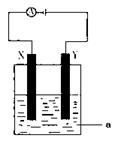
①若X和Y均为惰性电极,a为CuSO4溶液,
则阳极的电极反应式为,电解时的化学反应方程式为,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为
③若用此装置电解精炼铜,做阳极,电解液CuSO4的浓度(填“增大”、“减小”或“不变”)。
④若用此装置在铁制品上镀铜,铁制品做,电镀液的浓度(填“增大”、“减小”或“不变”)。