右图为实验室制氢气的简易装置。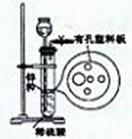
若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是
①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
| A.①③⑤ | B.①②③ | C.④⑤⑥ | D.①②③⑤ |
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为()
2SO3经一段时间后,SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04 mol/(L·s)。则这段时间为()
| A.0.1s | B.2.5s | C.5s | D.10s |
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是()
| A.该反应为吸热反应 |
| B.a与b相比,a的反应速率更快 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.反应物吸收的总能量小于生成物释放的总能量 |
如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是()
| A.1 mol H2中的化学键断裂时需要吸收436 kJ能量 |
| B.2 mol HCl分子中的化学键形成时要释放862 kJ能量 |
| C.此反应的热化学方程式为:H2(g)+Cl2(g)===2HCl(g) ΔH=+183 kJ/mol |
| D.此反应的热化学方程式为:H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ/mol |
下列与化学反应原理相关的叙述不正确的是()
| A.放热反应中生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.盖斯定律实质上是能量守恒定律的体现 |
| D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡 |
右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中b点代表的是( )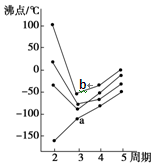
| A.H2S | B.HCl |
| C.PH3 | D.SiH4 |