11.6 gFe3O4加到100 mL某浓度的盐酸中,再加入9.8 g铁粉,反应停止时,溶液中无固体存在。向溶液中滴加硫氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化成Fe(OH)2,共消耗5.0 mol·L-1NaOH溶液160mL。则原盐酸的物质的量浓度为( )
| A.2 mol·L-1 | B.4 mol·L-1 | C.6 mol·L-1 | D.8 mol·L-1 |
下列有关物质的性质或应用的说法正确的是
| A.煤的干馏和石油的分馏均属化学变化 | B.聚乙烯的结构简式为CH2===CH2 |
| C.盐析可提纯蛋白质并保持其生理活性 | D.石油分馏可获得乙烯、丙烯和丁二烯 |
下列说法正确的是
A.油脂和蛋白质均属于高分子化合物
B.二氧化硅是太阳能电池的主要材料
C.Na、C、S都能直接与氧气反应,生成两种相应的氧化物
D.蔗糖、麦芽糖的分子式都是C11H12O11,二者互为同分异构体
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是
| A.N5+ 离子中含有36个电子 | B.H2与H3属于同素异形体 |
| C.C60的摩尔质量为720 | D.O2与O4属于同位素 |
下图为人体在某项生理过程中发生的化学反应示意图。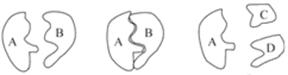
(1)图中标有字母的物质中,__ ___代表酶,其化学成分主要是__ ___,其基本组成单位是_ ____。
(2)如果B代表油脂,则C和D各代表_ ____ 。
(3)下列关于基本营养物质的说法正确的是__ ___ 。
| A.淀粉和纤维素分子式相同,两者是同分异构体 |
| B.糖类、油脂、蛋白质都是高分子化合物 |
| C.葡萄糖和果糖是同分异构体 |
| D.糖类、油脂、蛋白质在催化剂的作用下都能发生水解反应 |
反应H2(g)+ I2(g) 
 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键 ②单位时间内生成n molI2的同时生成2n molHI
| A.②④⑤⑥ | B.②③④⑤ | C.①③④⑤ | D.全部 |