当向蓝色的CuSO4溶液中逐滴加入氨水时,观察到首先生成蓝色沉淀,而后沉淀又逐渐溶解成为深蓝色的溶液,向深蓝色溶液中通入SO2气体,又生成了白色沉淀:将白色沉淀加入稀硫酸中,又生成了红色粉末状固体和SO2气体,同时溶液呈蓝色,根据上述实验现象分析推测,下列描述正确的是
| A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子 |
| B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应 |
| C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,Cu+只被氧化 |
| D.反应过程中消耗的SO2与生成的SO2的物质的量相等 |
据最新报道,科学家发现了如下反应:O2+PtF6=O2PtF6,已知O2PtF6是离子化合物,其中阴离子为PtF6-。下列说法正确的是
| A.该离子化合物中1 mol阳离子共有15 mol电子 |
| B.在此反应中O2是氧化剂,PtF6是还原剂 |
| C.每生成O2PtF61mol转移2 mol电子 |
| D.该离子化合物中只含离子键 |
在200 mL 1 mol/L的NaHCO3溶液中,加入一定量的单质或化合物X,恰好使其转化为只含Na2CO3溶质的溶液(不考虑溶质的水解),实现转变的物质X有多种,符合条件的X物质的一组是
| 编号 |
A |
B |
C |
D |
| X的化学式 |
Na |
Na2O |
Na2O2 |
NaOH |
| 加入X的质量(g) |
4.8 |
6.4 |
7.8 |
16.0 |
设NA表示阿伏加德罗常数的值。下列说法中正确的是
| A.5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA |
| B.16 g氧气或臭氧的氧原子个数均为NA |
C.1 mol石墨或金刚石中六元环个数均为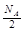 |
| D.28.6 g Na2CO3·10H2O在晶体中或溶液中,含有的CO32—离子均小于0.1 NA |
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数: B>A>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
关于下列图示的说法中,正确的是 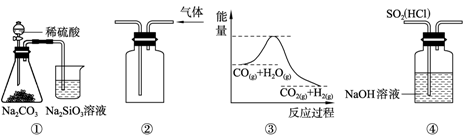
| A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集CO2气体 |
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH大于0 CO2(g)+H2(g)的ΔH大于0 |
| D.图④ 装置可以用来除去SO2中的HCl |