某溶液中只含有Na2SO4、Na2CO3和NaCl三种溶质。欲证明其中SO42-、CO32-、Cl- 三种阴离子确实存在,我们设计了如下实验,请你认真填写下面的实验报告。
| 实验步骤 |
实验现象 |
结论 |
| 1、向盛放溶液的试管中加入足量 。 |
有气泡产生 |
证明有CO32- |
 2、继续向试管中加入足量 溶液 |
有白色沉淀生成 |
证明有 。 |
| 3、过滤,向滤液中加适量的 溶液 |
有白色沉淀生成 |
证明有  。 。 |
下列有关化学实验的操作或说法中,正确的是(填字母代号)。
| A.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合 物变稠,即可得到肥皂 |
| B.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度 |
| C.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可 |
| D.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得硫酸亚铁晶体 |
E.进行纤维素水解实验时,把一小团蓬松脱脂棉放入试管,滴入少量浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu(OH)2加热至沸腾即可
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G.用50mL量筒量取3.80mL盐酸 H.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
1.中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有(填写编号)。
2.下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________。
| A.①是量筒,读数为2.5mL |
| B.②是量筒,读数为2.5mL |
| C.③是滴定管,读数为2.5mL |
| D.②是温度计,读数是2.5℃ |
⑴在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是(填编号)。
①分馏石油时用的温度计②制备乙烯时用的温度计
③用水吸收溴化氢的导管口④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
已知有一白色粉末是由NaCl、Na2SO4、Na2CO3、CuSO4、MgCl2中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是 __;
(2)若推测该粉末只由Na2SO4组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
| 实验步骤 |
实验现象 |
反应离子方程式和结论 |
| ④ |
注:实验步骤的序号由你按顺序编号。实验现象、离子方程式和结论要与相应的实验步骤一一对应。
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl.3•6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是_________________________ ______;
(2)反应前向A中放入碎瓷片的目的是_______________________________,装置A、B、E、三处均需要加热,A、B、E三处加热的先后顺序是(用A、B、E表示) ;
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。向滤液中加入KSCN溶液,溶液不显红色,说明滤液中不含有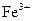 离子,你认为滤液中不含有
离子,你认为滤液中不含有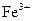 离子可能的原因是:__________________________________________。
离子可能的原因是:__________________________________________。
(4)该小组利用(3)中滤液制取FeCl3•6H2O晶体设计流程如下:
①步骤I若向100mL滤液中通入224mL Cl2(标准状况下)恰好完全反应,则原滤液中金属离子浓度约为__________mol/L。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
_______________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合必要的离子方程式简要说明)
__________________________________________________________________。