关于实验操作下列说法正确的是
| A.粗盐提纯溶解粗盐时,应多加水尽量使溶液稀些,防止食盐溶解不完全。 |
| B.粗盐提纯滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩。 |
| C.粗盐提纯当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干。 |
| D.将制得的晶体转移到新制过滤器中用大量水进行洗涤 |
实验是化学研究的基础,下列各图所示的实验方法、装置或操作正确的是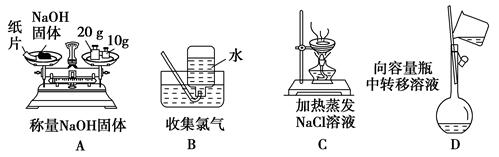
下列叙述正确的是
| A.将40 gNaOH溶于1L水中,所得NaOH溶液的浓度为1 mol·L-1 |
| B.将2.3gNa投入到97.7g水中充分反应,所得溶液中溶质的质量分数为4.0% |
C.在t℃时,将a g NH3完全溶液水,得到VmL溶液。该溶液的物质的量浓度为 mol·L-1 mol·L-1 |
| D.1 mol·L-1的硫酸溶液中c(H+)=1 mol·L-1 |
下列离子方程式书写正确的是
| A.碳酸钙与盐酸反应:CO32-+2H+===H2O+CO2↑ |
| B.硫酸氢钠溶液中加入足量的烧碱溶液:HSO4-+OH-=== SO42-+H2O |
| C.过氧化钠与水反应:2O22-+2H2O===4OH- + O2↑ |
| D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O |
NA为阿伏加德罗常数,下列说法正确的是
| A.0.5mol·L-1 Na2SO4溶液中所含的Na+数为NA |
| B.常温常压下,4g氦气所含有的质子数为4NA |
| C.1molCl2与足量Fe反应,转移的电子数为3NA |
| D.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
常温下,某无色透明的溶液中,下列各组离子能够大量共存的是
| A.H+、Na+、Cl-、CO32- |
| B.Ba2+、Na+、SO42-、Cl- |
| C.MnO4-、K+、I-、H+ |
D.Mg2+、Cl-、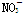 、H+ 、H+ |