下列制取单质的反应中,还原剂是化合物是( )
| A.用锌和稀硫酸反应制取氢气 |
| B.用氢气和灼热的氧化铜反应制取铜 |
| C.用碳和高温水蒸气反应制取氢气 |
| D.用氯气和溴化钠溶液制取溴 |
下列有机物中,不属于烃的衍生物的是
| A.氯丁烷 | B.甲苯 | C.硝基苯 | D.乙酸 |
最近我国接连发生多起煤矿爆炸事故,造成重大人员伤亡和财产损失。煤矿发生爆炸事故的元凶是煤矿坑道气中含有的甲烷。下列关于甲烷的叙述中错误的是
| A.甲烷分子是一种呈正四面体型的、含极性键的非极性分子 |
| B.甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 |
| C.甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 |
| D.“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
下列说法正确的是
| A.淀粉、纤维素、油脂、蛋白质都属于天然高分子形成的混合物 |
B.蔗糖溶液中加入新制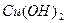 浊液煮沸会析出红色沉淀 浊液煮沸会析出红色沉淀 |
C.纤维素、淀粉都可用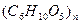 表示,但它们并不为同分异构体 表示,但它们并不为同分异构体 |
| D.人体的各种组织的蛋白质不断分解,最终生成二氧化碳和水,排出体外 |
下列转化不属于煤或石油的综合利用的是
| A.将煤干馏制得煤焦油和焦炭 |
| B.在一定条件下将煤与氢气转化为液体燃料 |
| C.将煤变为煤饼作燃料 |
| D.将石油裂解制得乙烯等化工原料 |
取一支大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,用铁架台固定好。放在光亮处一段时间。下列对观察到的现象的描述及说明正确的是
| A.试管中气体颜色变浅,是因为发生了加成反应 |
| B.试管中有少量白雾生成,这是氯化氢的小液滴 |
| C.试管内壁出现油状液体,这是甲烷与氯气的混合溶液 |
| D.试管内壁出现油状液体,这是CH3Cl小液滴 |