用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.100mL 0.1mol·L-1的稀硫酸中含有SO42—个数为0.1NA |
| B.1molCH3+(碳正离子)中含有电子数为10NA |
| C.27g金属铝与足量的盐酸反应,铝失去电子数为3NA |
| D.12.4g白磷(分子式为P4)中含有磷原子数为1.6NA |
有反应A2+B2 2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是
2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是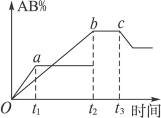
| A.AB为气体,A2、B2中必有一种为非气体;正反应吸热 |
| B.AB为气体,A2、B2中必有一种为非气体;正反应放热 |
| C.AB为固体,A2、B2中必有一种为非气体;正反应放热 |
| D.A2、B2、AB均为气体;正反应吸热 |
下列叙述正确的是
| A.ΔH>0的化学反应一定不能自发进行 |
B.反应2NO2(g) N2O4(l)的熵(体系的混乱度)增大(即ΔS>0) N2O4(l)的熵(体系的混乱度)增大(即ΔS>0) |
| C.混合物中各组分的百分含量改变,化学平衡不一定发生移动 |
| D.混合体系的压强发生改变,化学平衡一定发生移动 |
在密闭容器中进行反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示。符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示。符合图示的正确判断是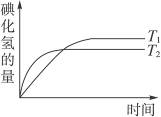
| A.T1>T2,ΔH>0 | B.T1>T2,ΔH<0 |
| C.T1<T2,ΔH>0 | D.T1<T2,ΔH<0 |
下列关于化学反应的熵变的叙述正确的是
| A.化学反应的熵变与反应的方向无关 |
| B.化学反应的熵变直接决定了反应的方向 |
| C.熵值增大的反应都是混乱度增大的反应 |
| D.熵值增大的反应都能自发进行 |
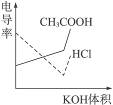
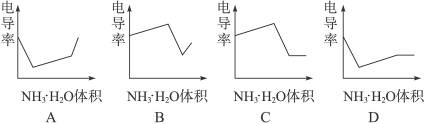
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是