配制100 mL 1.0 mol·L-1Na2CO3溶液,下列操作正确的是
| A.称取28.6 g Na2CO3.10H2O,加入100 mL容量瓶中,加水溶解、定容 |
| B.称取 10.6 g Na2CO3,在烧杯中加入100 mL蒸馏水,搅拌、溶解 |
| C.定容后,塞好瓶塞,反复倒转、摇匀 |
| D.转移时用玻璃棒引流碳酸钠溶液及洗涤液至容量瓶中,再加蒸馏水至刻度线 |
用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是
| A.Na2SO4 | B.NaOH | C.HCl | D.NaCl |
由2—氯丙烷制取少量的1,2—丙二醇时,需要经过下列哪几步反应
| A.消去、加成、消去 | B.加成、消去、取代 |
| C.取代、消去、加成 | D.消去、加成、取代 |
下列化学反应的热量变化可用:H+(aq) + OH-(aq) = H2O(l),△H= —57.2kJ/mol表示的是
| A.含有1molH2SO4的浓硫酸与含有1molNaOH的稀溶液混合 |
| B.0.1 mol/L 的醋酸溶液与 1mol/L的NaOH溶液等体积混合 |
| C.1mol/L的盐酸10mL与1mol/L的NaOH15mL混合 |
| D.1mol/L的盐酸10mL与1mol/L的氨水15mL混合 |
下列各组混合物都能用分液漏斗分离的是
| A.乙酸乙酯和水 酒精和水 己烯和水 | B.二溴乙烷和水 溴苯和水 硝基苯和水 |
| C.甘油和水 己烷和水 甲酸和水 | D.苯和甲苯 乙醛和水 乙酸和乙醇 |
与图键线式的物质(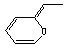 )互为同分异构体的是
)互为同分异构体的是