已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化 Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
| A.Fe3+ | B.MnO4- | C.Cl2 | D.HNO3 |
从石英砂制取并获得高纯硅的主要化学反应如下:
① SiO2+2C Si(粗)+2CO
Si(粗)+2CO
② Si(粗)+2Cl2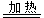 SiCl4
SiCl4
③ SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是
| A.①、③是置换反应,②是化合反应 |
| B.高温下,焦炭与氢气的还原性均强于硅 |
| C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子 |
| D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅 |
下列有关实验的说法正确的是
| A.将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 |
| B.测量溶液的导电性可区分出试剂盐酸和醋酸,导电能力强的是盐酸 |
| C.做完银镜反应后的试管可用热的稀硝酸清洗,回收后的硝酸银溶液可再利用 |
| D.除去硫酸铝溶液中混有的硫酸镁,可加入足量烧碱,过滤,向滤液中加入适量硫酸酸化 |
2007年诺贝尔化学奖获得者德国科学家格哈德·埃特尔在表面化学研究领域作出了开拓性贡献。化学家将研究气体与固体(或液体)在界面上所发生的物理化学现象的科学称为表面化学。对下列现象的研究不属于表面化学范畴的是
| A.氯化银在水中的溶解平衡 | B.氢氧燃料电池中电极上的反应 |
| C.铁在潮湿的空气中生锈 | D.氮气与氢气在铁触媒作用下化合 |
在一定温度下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间生成n mol的A2同时生成n mol的AB |
| B.容器内的总压强不随时间变化 |
| C.单位时间生成2n mol的AB同时生成n mol的B2 |
| D.单位时间生成n mol的A2同时生成n mol的B2 |
反应:L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断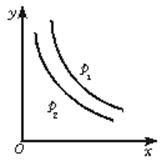
| A.上述反应是放热反应 | B.上述反应是吸热反应 |
| C.a>b | D.a<b |