若50滴水正好是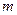 mL,水在该条件下密度为1g/ mL.则1滴水所含的分子数是
mL,水在该条件下密度为1g/ mL.则1滴水所含的分子数是
A.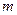 ×50×18×6.02×10 ×50×18×6.02×10 23 23 |
B.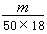 ×6.02×1023 ×6.02×1023 |
C.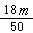 ×6.02×1023 ×6.02×1023 |
D. 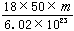 |
将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是()
下列有关说法正确的是()
| A.CO2、CH4、N2等均是造成温室效应的气体 |
| B. 14C可用于文物鉴定,14C与12C互为同素异形体 |
| C.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
D.精炼粗铝时要清除坩埚表面的石英砂,铝与石英砂反应的方程式为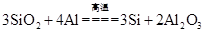 |
可以用来检验碳酸氢钠粉末中是否混有碳酸钠的实验方法是()
| A.加热,看有无气体放出 |
| B.滴加盐酸,看有无气体放出 |
| C.溶于水后,滴加稀的氯化钡溶液看有无白色沉淀生成 |
| D.溶于水后,滴加澄清石灰水看有无白色沉淀生成 |
下列关于硅单质及其化合物的说法正确的是()
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
| A.①② | B.①④ | C.②③ | D.③④ |
据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不妥的是()
| A.便于运输、储存,从安全角度考虑,硅是最佳的燃料 |
| B.自然界的含硅化合物易开采 |
| C.硅燃烧放出的热量大,燃烧产物对环境污染程度低且容易有效控制 |
| D.自然界中存在大量单质硅 |