在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,对m和R3+判断正确的是
A.m=4, R3+是氧化产物 R3+是氧化产物 |
B.m=2y,R3+是氧化产物 |
| C.m=2,R3+是还原产物 | D.m=y,R3+是还原产物 |
下列说法错误的是
| A.从1L 1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L |
| B.制成0.5L 10mol/L的盐酸,需要氯化氢气体112L(标准状况) |
| C.10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
| D.0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 |
下列各溶液中,Na+ 物质的量浓度最大的是
| A.4L 0.5 mol/L NaCl溶液 | B.5L 0.4mol/L NaOH溶液 |
| C.2L 0.15mol/L Na3PO4溶液 | D.1L 0.3mol/L Na2SO4溶液 |
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
| A.0.1(b-2a)mol/L | B.10(2a-b)mol/L |
| C.10(b-a)mol/L | D.10(b-2a)mol/L |
下列各组物质分类正确的是
| 酸 |
碱 |
盐 |
氧化物 |
|
| A |
H2SO4 |
Na2CO3 |
NaCl |
SiO2 |
| B |
HBr |
NaOH |
Na2CO3 |
CaO |
| C |
CO2 |
NH3·H2O |
NaHCO3 |
CuO |
| D |
CH3COOH |
KOH |
KCl |
HClO3 |
右图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于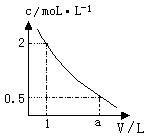
| A.2 | B.3 | C.4 | D.5 |