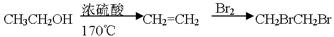短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
最高正价和最低负价的绝对值之差为2 |
| B |
原子核外P亚层电子数比S亚层电子数多1 |
| C |
1molC单质能与冷 水反应,在标准状况下生成11.2LH2 水反应,在标准状况下生成11.2LH2 |
| D |
原子最外层电子数等于其周期序数 |
| E |
负一价阴离子的电子层结构与Ar原子相同 |
①D原子结构示意图为____________;A在周期表中的位置为________________;
②用电子式表示B和C形成的化合物 ___________;
③B和D简单离子的半径大小为__________;(用离子符号和“>”、“=”或“<”表示)
④元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水合物的酸性
⑤E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为___________________。
用A+、B-、C2―、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是、B元素是、C元素是(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是。
(4)F是由两种元素组成的三原子分子,其分子式是,结构式是。
(5)G分子中含有4个原子,在MnO2催化作用下能生成一种无色无味的气体,该反应方程式为。
(6)H分子中也含有4个原子,其分子式是。该分子是分子(填“极性”或“非极性”)
工业制造金刚砂(SiC)的化学方程式如下:SiO2+3C SiC+2CO↑在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是________。
SiC+2CO↑在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是________。
写出以下物质中所含化学键的类型。
(1)Cl2_________;(2)NaOH_________;(3)NaCl________。
已知A的产量通常用来衡量一个国家的石油化工水平,D的结构可用右下图模型表示。现以A为主要原料合成F和高分子化合物E,其合成路线如下图所示。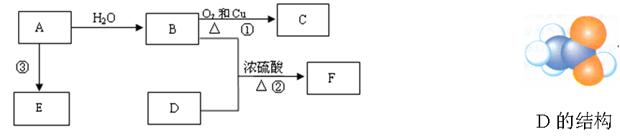
(1)A的结构式为。 B中含官能团名称为 ;
;
(2)写出反应的化学方程式
①:反应类型:
②:反应类型:
(3)实验室怎样鉴别B和D?
(4)在实验室里我们可以用如图所示的装置来制取F,乙中所盛的试剂为,该溶液的主要作用是;该装置图中有一个明显的错误是。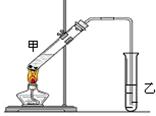
氯乙烯是合成聚氯乙烯的单体。乙烯氧化法是生产氯乙烯的主要方法。分三步进行,如下图所示: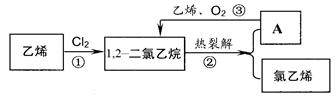
(1)关于乙烯、氯乙烯、聚氯乙烯说法正确的是__________(填字母)
| A.都能在氧气中燃烧 | B.都能发生加成反应。使溴水褪色 |
| C.都能使得酸性高锰酸钾褪色 | D.氯乙烯分子中所有原子共平面 |
(2)从环境角度考虑,氧化法的优点是 。
(3)请写出②对应的化学方程式 。
(4)试以乙烯为原料通过反应合成医药和染料工业产品中常用 的中间体——草酸二乙酯(C2H5OOCCOOC2H5)(用反应流程图表示,并注明反应条件)。
的中间体——草酸二乙酯(C2H5OOCCOOC2H5)(用反应流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选;②合成反应流程图表示方法示例如下:由乙醇合成二溴乙烷的反应流程图可表示为