某无色混合气体,依次通过浓硫酸和过氧化钠时,气体体积不断减少,最后气体变成红棕色,该混合气体的组成是
| A.N2、NO、NH3 | B.NH3、CO2、N2 |
| C.NH3、CO2、NO | D.NH3、N2、NO2 |
将含0.4 mol/LCu(NO3)2和0.4 mol/L KCl的水溶液500 mL,用惰性电极电解一段时间后,在一个电极上析出0.15 mol Cu,此时在另一电极上放出气体,在标准状况下约为()
| A.5.6 L | B.6.72 L | C.2.8 L | D.8.4 L |
在25℃时,向50.00 mL未知浓度的CH3COOH溶液中逐滴加入0.5 mol·L-1的NaOH溶液。滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是()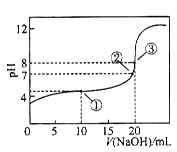
| A.该滴定过程可采用酚酞做指示剂 |
| B.图中点③所示溶液中,c(CH3COO-)<c(Na+) |
| C.图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D.滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的关系存在 |
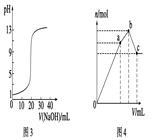
下列图示与对应的叙述不相符的是()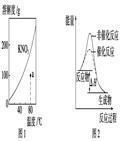
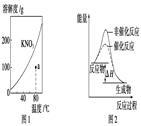

| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的过饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸溶液得到的滴定曲线 |
| D.图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强 |
如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )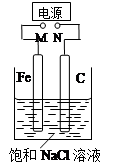
| A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1 mol NaOH |
| B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 |
| C.M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
| D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 |
下列说法正确的是( )
A.反应2Mg+CO2 2MgO+C ΔH<0从熵变角度看,可以自发进行 2MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |