下列有关NaHCO3和Na2CO3性质的比较中,正确的是( )
| A.热稳定性:Na2CO3<NaHCO3 |
| B.常温时在水中的溶解度:Na2CO3<NaHCO3 |
| C.等质量的NaHCO3和Na2CO3与稀盐酸反应产生CO2的量:Na2CO3<NaHCO3 |
| D.等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多 |
某有机物(化学式为C8H10O)有多种同分异构体,其中属于芳香醇的同分异构体一共有
| A.6种 | B.5种 | C.4种 | D.3种 |
常温常压下,向2L密闭容器中加入一定量的A和B气体,发生反应2A(g) + 2B(g) 2Q(g) + W(g)∆H=M kJ·moL−1,3min后,反应达到平衡,相关数据如下表:
2Q(g) + W(g)∆H=M kJ·moL−1,3min后,反应达到平衡,相关数据如下表:
| 反应时间/min |
n(A)/mol |
n(B)/mol |
| 0 |
4 |
4 |
| 0.5 |
3.2 |
|
| 2 |
2.4 |
|
| 3 |
1.0 |
下列说法正确的是
A.反应在前0.5min时,n(W)=0.6mol
B.2min时,反应的平均反应速率为V(Q)=0.48mol/L·s
C.相同温度条件下,向平衡后的容器中再充入2molQ和2molW时,v (正)> v (逆)
D.相同温度下,平衡时的平衡常数为18L·mol-1
W、X、Y、Z四种短周期元素。已知X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强。下列说法正确的是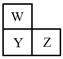
| A.原子半径大小比较:Z>Y>W>X |
| B.Z能够形成HZO3型化合物 |
| C.W与X形成的化合物只含有离子键 |
| D.W、X、Z只能形成一种化合物 |
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。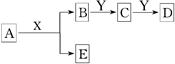
下列推断正确的是
A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
密闭容器中,发生反应:CO(g) + 2H2(g) CH3OH(g) △H<0,下列说法正确的是
CH3OH(g) △H<0,下列说法正确的是
| A.一定温度下,压缩容器体积,则正反应速率加快,逆反应速率减慢 |
| B.若v生成(CH3OH)=v消耗(CO),则该反应达到平衡状态 |
C.升高温度,重新达到平衡时,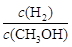 增大 增大 |
| D.使用催化剂,反应的平衡常数增大 |