25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |
下列叙述中不正确的是()
| A.电解池的阳极发生氧化反应,阴极发生还原反应 |
| B.原电池跟电解池连接后,电子从电池负极流向电解池阳极 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
如下图所示是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是()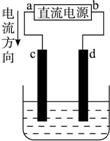
| A.a为负极,b为正极 |
| B.a为阳极,b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是()
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
用惰性电极实现电解,下列说法正确的是()
| A.电解稀硫酸溶液,实质是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比是1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
能用电解原理说明的问题是( )
①电解是把电能转变成化学能
②电解是化学能转变成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必须导致氧化还原反应的发生
| A.①②③④ | B.②③⑤ | C.③④ | D.①③④⑤ |