已知热化学方程式:
H2(g)+1/2O2(g)=H2O(l) △H="-285.8KJ/mol" 当lg液态水变为水蒸汽时,其热量变化是
| A.吸热88kJ | B.吸热2.44J | C.放热44kJ | D.吸热44kJ |
在气相条件下(T="500" K),有相同体积的甲、乙两容器,甲容器充入1 g SO2、l gO2,乙容器充入2 g SO2、2g O2则下列叙述中正确的是
| A.化学反应速率:乙>甲 | B.平衡后SO2的浓度:乙>甲 |
| C.SO2转化率:乙<甲 | D.平衡后O2的体积分数:乙>甲 |
下列可逆反应中,正反应是吸热反应的是
A.PCl3(l)+Cl2(g) PCl5(s) 降温,PCl3转化率增大 PCl5(s) 降温,PCl3转化率增大 |
B.NO2(g)+SO2(g) NO(g)+SO3(g) 降温,SO3的体积分数增加 NO(g)+SO3(g) 降温,SO3的体积分数增加 |
C.2NO2 (g) 2NO(g)+O2(g) 降温,颜色加深 2NO(g)+O2(g) 降温,颜色加深 |
D.CS2(l)+2H2O(g) CO2(g)+2H2S(g) 升温,CO2的平衡浓度增大 CO2(g)+2H2S(g) 升温,CO2的平衡浓度增大 |
下列事实中,不能用勒沙特列原理解释的是
| A.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| B.工业合成氨时选择铁做催化剂能极大加快反应速率 |
| C.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
已知H2(g)+Br2(l)=2HBr(g);△H=-72KJ/mol,蒸发1mol Br2(l)需要吸收的能量为30KJ,其他的相关数据如右表:
则表中a为
| A.404 | B.260 | C.230 | D.200 |
右图是373K时N2与H2反应过程中能量变化的曲线图。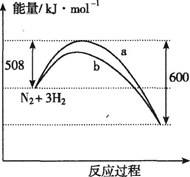
下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2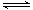 2NH3 △H=-92kJ·mol-1 2NH3 △H=-92kJ·mol-1 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热不变 |
| D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1 |