
A .0.025 mol/(L·s) B.0.125mol/(L·s) C.0.05 mol/(L·s) D.0.1 mol/(L·s)
.0.025 mol/(L·s) B.0.125mol/(L·s) C.0.05 mol/(L·s) D.0.1 mol/(L·s)
对相同质量的SO2和SO3来说,下列关系正确的是
①含氧原子个数比为2:3 ②含硫原子个数比为1:1
③含硫元素质量比为5: 4 ④含氧元素质量比为5:6
| A.①② | B.①②③④ | C.①②③ | D.③④ |
设NA为阿佛加德罗常数,下列叙述中正确的
| A.标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA |
| B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA |
| C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA |
| D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA |
关于下列图示的说法中正确的是 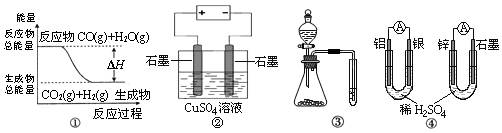
A.图①表示CO(g)+H2O(g) CO2(g)+H2(g)是放热反应 CO2(g)+H2(g)是放热反应 |
| B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1︰1 |
| C.图③实验装置可一次而又科学准确的完成比较Cl2、Br2、I2单质氧化性强弱的实验 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
下列化学反应的离子方程式正确的是
| A.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O |
| D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(已知:还原性I->Fe2+>Br->Cl-)
| A.7∶1 | B.7∶2 | C.7∶3 | D.7∶4 |