下列有关反应热的比较判断中,正确的个数是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1; CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2;
上述两反应中的ΔH1>ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH3; H2(g)+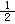 O2(g)=H2O(l) ΔH4;
O2(g)=H2O(l) ΔH4;
上述两反应中的ΔH3>ΔH4
③t℃时,在一定条件下(起始的体积和压强相同),将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
上述两反应中的Q1>Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH5; CaO(s)+H2O(l)=Ca(OH)2(s) ΔH6
上述两反应中的ΔH5>ΔH6
| A.1个 | B.2个 | C.3个 | D.4个 |
下列离子方程式不正确的是
| A.用CH3COOH溶解CaCO3:CaCO3+2H+==Ca2++H2O+CO2↑ |
| B.金属钾与水反应:2K+2H2O==2K++2OH-+H2↑ |
| C.氧化铝溶于NaOH溶液:Al2O3+2OH-==2AlO2-+H2O |
| D.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3- |
R、W、X、Y、Z五种短周期元素在周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
| R |
W |
|
| X |
Y |
Z |
A.R、W、Y的原子半径依次增大
B.R、X、Y的简单氢化物的稳定性依次增强
C.W、Y、Z形成的单核阴离子还原性依次增强
D.X、Y、Z的最高价氧化物对应水化物的酸性依次增强
如图所示装置中,电流表G指针发生偏转,同时X极放出气体,Y极逐渐变细。下列判断正确的是
| A.X是Zn,Y是Cu,Z为稀HCl溶液 |
| B.X是Cu,Y是Zn,Z为稀H2SO4溶液 |
| C.X是Cu,Y是石墨,Z为稀AgNO3溶液 |
| D.X是石墨,Y是Fe,Z为稀AgNO3溶液 |
欲除去下列物质中混入的少量杂质(括号内为杂质),所选试剂和分离方法都正确的是
| A.甲烷(乙烯):KMnO4溶液洗气 | B.苯(Br2):NaOH溶液蒸馏 |
| C.NaCl溶液(MgCl2):KOH溶液过滤 | D.硝基苯(硝酸):蒸馏水分液 |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.1 mol苯分子中含有C=C双键数目为3NA |
| B.标准状况下,11.2 L CCl4中含有的共价键数目为2NA |
| C.1 mol乙烯和乙醇的混合物完全燃烧时消耗O2的分子数为3NA |
| D.常温常压下,17 g 羟基含有的电子总数为10NA |