(8分) 中学化学常见的物质A、B、C、D之间存在如图所示的转化关系,其中反应条件已省略。请按要求填空: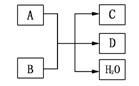
(1)若A为黑色固体单质,C、D均能使石灰水变浑浊,则该反应的化学方程式为_______________________。
(2)若A为黑色粉末,C能使品红溶液和石蕊试液褪色,则该反应的离子方程式为_____________________________________。
(3)若A为常见的碱,其溶解度随温度的升高而降低,D可作干燥剂,则C的水溶液呈____(填“酸性”、“碱性”或“中性”),其原因是________________________。
(4)若 A为红色金属单质,其质量为1.92g,与过量的B在常温下反应,用容器将全部的无色气体C收集起来,然后倒扣在水中,需通入标准状况下VmL的氧气
A为红色金属单质,其质量为1.92g,与过量的B在常温下反应,用容器将全部的无色气体C收集起来,然后倒扣在水中,需通入标准状况下VmL的氧气 恰好使C气体完全转化为B,则V=________。
恰好使C气体完全转化为B,则V=________。
有如下两个反应:
A 2HCl+Ba(OH)2===BaCl2+2H2O
B 2Fe3++Cu==2Fe2++Cu2+
(1) 根据两反应的本质,判断能否设计成原电池:AB(填“能”或“不能” )不能设计成原电池的原因是
(2) 根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是_______,正极材料是________,电解质溶液是 ___;
②写出负极的电极反应式 _;
③原电池工作时溶液中的Cl-从__________极向________极移动(填正或负)
④若导线上转移电子0.2mol,则负极质量变化是 ___ 减少 ___; 将此反应设计成原电池,若电解质溶液为H2SO4,
将此反应设计成原电池,若电解质溶液为H2SO4,
请写出正负极的电极反应;负极:_______________;正极:______________。
A、B、C、D、E、F六种元素为元素周期表中的前20号元素,0.5molA的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等。B元素原子核外电子数比A元素原子核外电子数多1;Cˉ离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍;E的氯化物ECl21.11g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,且E的核内中子数为20;F的最高价氧化物对应的水化物可以与其氢化物发生反应生成盐。请填写下列空格:
(1)推断A、B、C、D、E、F六种元素的符号A_________;B_________;C________;D________; E_________;F_________
(2)C的一价阴离子的结构示意图__________________;
(3)D元素的最高价氧化物的结构式是_______________;
(4)C、D两元素形成的化合物电子式______________,分子内含有_______键(填极性或非极性)。
(5)55.5gECl2中所含质子的物质的量为__________mol。
下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~ (4)小题用元素符号或化学式回答,(5)~(7)小题按题目要求回答。
| 族 周期 |
I A |
Ⅱ A |
Ⅲ A |
Ⅳ A |
Ⅴ A |
Ⅵ A |
Ⅶ A |
O |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是,氧化性最强的单质是,还原性最强的单质是.
(2)最高价氧化物的水化物碱性最强的是,酸性最强的是。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的,
(4)在B、C、E、F、G、H中,原子半径最大的是,
(5)A和E组成化合物类型(填“离子化合物”或“共价化合物”);它比A和F组成化合物的沸点(填“高”或“低”),原因是
(6)用电子式表示B的最高价氧化物对应的水化物的形成过程
(7)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
。
天然气(主要成分是甲烷)是一种清洁、高效的能源,现在许多城市家庭用于厨房使用的燃料已经由煤气(主要成分是H2和CO按体积比1︰1混合的气体混合物)换成了天然气;此外天然气也是很好的燃料电池的燃料,甲烷在燃料电池中的能量转换率可达到85%—90%。请回答下列问题:
(1)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为:。随着反应的不断进行溶液的pH(填“增大”“减小”或“不变”)。
(2)如果以该燃料电池为电源、石墨作两极电解饱和食盐水,则该电解过程中阳极反应式为:;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12,则理论上消耗甲烷在标准状况下的体积为:mL。
(3)将(2)中电解结束后的溶液取出,向其中加入含有Mg2+和Fe2+的溶液甲,Mg(OH)2和Fe(OH)2同时生成,已知Mg(OH)2和Fe(OH)2在该温度下的溶度积常数分别是2×10—11和8×10—16,则甲溶液中Mg2+和Fe2+的浓度之比为:。
Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOCl2 ==="4LiCl" +S +SO2.请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为__________________;
(2)电池正极发生的电极反应为_____________________________________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______________________________
(4)组装该电池必须在无水、无氧的条件下进行,原因是
.
(5)用此蓄电池电解含有0. 1 mol CuSO4和0. 1 mol NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1 L,此时溶液的pH=。