计算: (1) 2mol NH3中含有____________________个NH3分子, ___________________个N原子,___________________个H原子;
(2)1mol CaCl2中含 ____mol Ca2+,______mol Cl-,共________mol离子
(3)H2SO4的摩尔质量是_________ _, 9.8g H2SO4的物质的量是______mol, ______g的硫元素,______g的SO42-。
_, 9.8g H2SO4的物质的量是______mol, ______g的硫元素,______g的SO42-。
(4)标准状况下有(1)6.72L CH4 (2) 3.01×1023个HCl分子(3)13.6g H2S,下列对这三种气体的关系从小到大的排列顺序是:
| A.物质的量______________ | B.体积___________________ |
| C.质量__________________ | D.氢原子数_______________ |
[化学与技术]
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子。该厂拟定如图所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是_________________________________
(2)②中使用的NaClO溶液呈碱性,用离子方程式解释原因_____________________。
(3)②中反应后无气体放出,该反应的离子方程式为____________________________。
(4)③中反应时,每0.4 mol Cr2O72-转移2.4 mol的电子,该反应的离子方程式为______________。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因。
二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ.某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g) 2ClNO(g) △H1< 0其平衡常数为K1
2ClNO(g) △H1< 0其平衡常数为K1
ii.2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) △H2<0其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) = ,平衡常数K2= ;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) = α2(NO2)(填“>”“<”或“=”)。
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是 。
| A.c(Na+) = c(HSO3-)+ 2c(SO32-) |
| B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—) |
| C.2c(Na+) =2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3) |
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如下图所示,则
①工作一段时间后,阴极区溶液的pH (填“增大”“减小”或“不变”);
②写出阳极的电极反应式 。
过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数列于下表。
| 分子式 |
外观 |
热分解温度 |
熔点 |
水溶性(20℃) |
| CO(NH2)2·H2O2 |
白色晶体 |
45℃ |
75—85℃ |
500g·L—1 |
合成过氧化尿素的流程及反应器的示意图如下: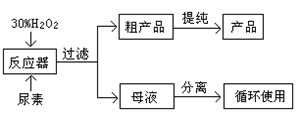
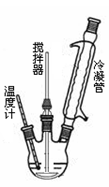
请回答下列问题:
(1)写出合成过氧化尿素的化学方程式 。
(2)反应器里冷凝管中冷水从 (填“上”或“下”)口流入;反应器的加热方式是 ________ 。
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是 。
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是 。
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:完成并配平下列化学方程式:
MnO4—+ H2O2+ H+= Mn2++ H2O+ 
②KMnO4溶液应盛放在 滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 (填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量 (填“合格”或“不合格”),活性氧的质量分数为 。
工业上制取硝酸铵的流程图如下,请回答下列问题: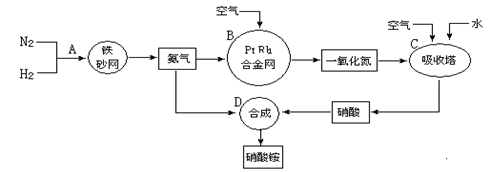
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:
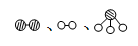 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| 注意事项 |
理由 |
|
| ① |
||
| ② |
二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g)ΔH1= a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2(g)ΔH2= b kJ•mol-1
2CO(g) + O2(g)=2CO2(g)ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g) 的ΔH= kJ•mol-1。
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2  CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点CO2的转化率高于b点,原因是_____________________________________。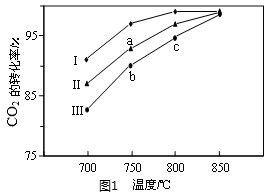
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现: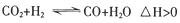 ,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3:
,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3: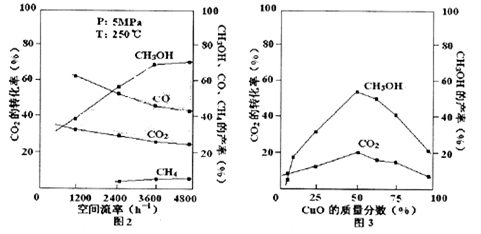
①由图2得,最佳空间流率为 h-1。
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,试说明不选择单组份ZnO原因是 。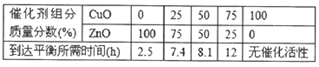
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
①该进行的反应的△S 0(填:“>”或“<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= 。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 (列举2项)。