某一反应物的物质的量浓度是1.0 mol·L-1,经过20 s后,它的浓度变成了0.2 mol·L-1,在这20 s内它的反应速率为
| A.0.04 | B.0.04 mol/(L.s) | C.0.8 mol/(L.s) | D.0.04 mol·L-1 |
下列装置或操作能达到实验目的的是 ()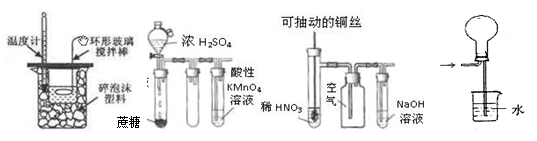
I II III IV
| A.实验I:中和热测定 |
| B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验IV:可用于HCl气体的吸收 |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ·mol-1 |
B.由N2(g)+3H2(g) 2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ 2NH3(g)△H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子时,反应放出的热小于92.4 kJ |
| C.HCl和NaOH反应的中和热△H="-57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1 |
| D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1 |
已知:2X+Y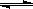 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是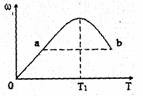
| A.T1时,v正>v逆 |
| B.正反应的△H<0 |
| C.a、b两点的反应速率va=vb |
| D.T<T1时,ω增大的原因是平衡向正方向移动 |
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。淀粉KI溶液中通入SO2气体,溶液无明显变化。则下列分析中正确的是
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I—反应,I—作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
下列离子方程式正确的是
| A.氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B.将铜丝投入稀硝酸中:Cu+4H++NO3-=Cu2++NO2↑+2H2O |
| C.将H2O2滴入酸性KMnO4溶液中:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O |
| D.NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |