25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05m ol/L的Ba(OH)2溶液,③pH=10的Na2S溶液
ol/L的Ba(OH)2溶液,③pH=10的Na2S溶液 ,④pH=5的NH4NO3溶液中,发生电离的水的物
,④pH=5的NH4NO3溶液中,发生电离的水的物 质的量之比是( )
质的量之比是( )
| A.1:10:1010:109 | B.1:5:5×109:5×108 | C.1:20: 1010:109 | D.1:10:104:109 |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.089 |
0.102 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
| A.L2+与R2-的核外电子数相等 |
| B.M与T形成的化合物具有两性 |
| C.氢化物的稳定性为H2T<H2R |
| D.单质与浓度相等的稀盐酸反应的速率为L<Q |
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是
| A.元素非金属性按X、Y、Z的顺序减弱 |
| B.阴离子的还原性按X、Y、Z的顺序减弱 |
| C.气态氢化物的稳定性按X、Y、Z的顺序增强 |
| D.单质的氧化性按X、Y、Z的顺序增强 |
下列说法正确的是
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
短周期金属元素甲~戊在元素周期表中的相对位置如右所示,下面判断正确的是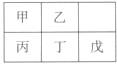
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |
A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不可能为
A.n+8 B.n+18 C.n+20 D.n+32